Окисно-відновні реакції
4. Складання рівнянь окисно-відновних реакцій
Електронний баланс - метод знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, в якому розглядається обмін електронами між атомами елементів, які змінюють свій ступінь окиснення.
Основою цього методу є наступне правило:
загальне число електронів, які віддали атоми-відновники, дорівнює загальному числу електронів, які приєднали атоми-окисники.
Розглянемо, як підібрати коефіцієнти, методом електронного балансу для рівняння реакції взаємодії калій хлориду з калій біхроматом у присутності сульфатної кислоти.
Алгоритм добору коефіцієнтів методом електронного балансу.
1. Записуємо схему реакції:
KCl + K2Cr2O7 + H2SO4 → Cl2 +Cr2(SO4)3 + K2SO4 + H2O.
2. Визначаємо ступені окиснення елементів у реагентах і продуктах реакції:
+1 −1 +1 +6 −2 +1 +6 −2 0 +3 +6 −2 +1 +6−2 +1 −2
KCl + K2Cr2O7 + H2SO4 → Cl2 +Cr2(SO4)3 + K2SO4 + H2O.
3. Знаходимо елементи, які змінили свій ступінь окиснення.
У нашому випадку це Хлор і Хром.
4. Визначаємо число електронів, які приєднав окисник і віддав відновник. Записуємо рівняння напівреакцій процесів окиснення та відновлення, враховуючи мінімальну кількість атомів, які беруть участь у цих процесах.
Молекула хлору складається з двох атомів, а формульні одиниці K2Cr2O7 і Cr2(SO4)3 містять по два атоми Хрому, тому складаємо рівняння напівреакцій для двох атомів Хлору і Хрому. В такому випадку кількість електронів, які віддає або приєднує один атом помножуємо на 2:
2Cl− − 2ē = Cl20
2Cr+6 + 6ē = 2Cr+3
5. Складаємо електронний баланс.
Щоб зрівняти кількість відданих і прийнятих електронів, рівняння першої напівреакції треба помножити на 6, а другої – на 2. Для цього досить перемістити числа відданих і прийнятих електронів проти верхнього і нижнього рядка так, як показано на схемі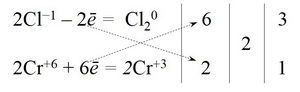
Щоб отримати мінімальні коефіцієнти числа 6 і 2, треба скоротити на 2, отримуємо коефіцієнти 3 і 1, які урівняють кількість відданих і прийнятих електронів.
6. Ці коефіцієнти ставимо перед речовинами, що містять елемент-окисник і елемент-відновник.
Зверніть увагу: оскільки ми визначали баланс для 2 атомів Хлору, то перед калій хлоридом ставимо загальний коефіцієнт 6.
6KCl+ K2Cr2O7 + H2SO4→3Cl2+Cr2(SO4)3 + K2SO4+H2O.
7. Добираємо коефіцієнти для всіх інших учасників реакції методом підбору.
6KCl+K2Cr2O7+ 7H2SO4=3Cl2+Cr2(SO4)3+ 4K2SO4 + 7H2O.
8. Перевіряємо правильність добору коефіцієнтів за елементом, який не зрівнювали. Найчастіше за Оксигеном:
7 + 7∙4 = 4∙3 + 4∙4 + 7
35 = 35.
9. Визначаємо окисник і відновник, процеси окиснення і відновлення: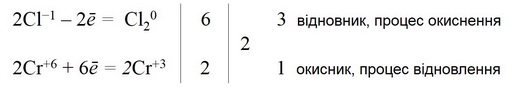
Відповідь: 6KCl + K2Cr2O 7+ 7H2SO4 = 3Cl2 + Cr2 (SO4)3 + 4K2SO4 + 7H2O.