Окисно-відновні реакції
| Сайт: | Online University from the Future |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Окисно-відновні реакції |
| Напечатано:: | Гість-користувач |
| Дата: | Воскресенье, 8 Февраль 2026, 19:41 |
1. Окисно-відновні реакції
Порівняємо реакції взаємодії сульфур(VІ) оксиду з водою та сірки з киснем:
SO3 + H2O = H2SO4;
S + O2 = SO2.
За кількістю реагентів і продуктів обидві реакції відносяться до одного і того ж типу – реакції сполучення.
Звернемо увагу на ступені окиснення елементів у вихідних речовинах і продуктах реакцій
S+6O3-2 + H2+O-2 = H2+S+6O4-2; (1)
S0 + O20 =S+4O2-2. (2)
Перша реакція відбувається без зміни ступенів окиснення елементів, а під час другої реакції ступені окиснення елементів змінились.
• Реакції, що супроводжуються зміною ступеня окиснення атомів елементів, називають окисно-відновними.
2. Процеси окиснення і відновлення
Розглянемо, що відбулося з атомами під час взаємодії сірки з киснем:
S0 + O20 =S+4O2-2.
Ступінь окиснення Сульфуру збільшився на 4 одиниці, це означає, що його атоми втратили по 4 електрони, а ступінь окиснення Оксигену зменшився на 2 одиниці – його атоми отримали по 2 електрони:
S0 - 4ē → S+4
О0 + 2ē → О−2
Елемент, атоми якого віддають електрони, окиснюється, ступінь окиснення його чисельно підвишується. В нашому випадку – це Сульфур.
Оксиген приєднує електрони і відновлюється, ступінь окиснення його чисельно знижується.
• Окиснення – процес віддачі електронів частинками, а відновлення – процес прийняття електронів.
3. Окисники й відновники
• Елементи, що приєднують електрони й понижують ступінь окиснення називають окисниками, а елементи, що віддають електрони і підвищують ступінь окиснення – відновниками.
Відповідно і частинки (йони, молекули), що містять елемент, який підвищує свій ступінь окиснення, називають відновниками, а ті, що містять елемент, який понижує свій ступінь окиснення, – окисниками.
У реакції взаємодії сірки з киснем:
S + O2 =SO2,
Сульфур віддає електрони і окиснюється, тому він виступає відновником, о Оксиген приєднує електрони і відновлюється, тому він виступає окисником.
Оскільки відновники – це речовини, що містять атоми, які втрачають електрони, то відновниками можуть бути речовини, що містять елементи не у вищому ступені окиснення:
- прості речовини неметали:
Mg + 2HCl = MgCl2 + H2,
Mg0 → Mg+2;
- бінарні сполуки неметалічних елементів з металічними елементами та Гідрогеном:
2NaI + Br2 = I2 + 2NaBr,
2I-1 → I2;
- метали та їх йони, здатні підвищувати свій ступінь окиснення:
2FeCl2 + Cl2 = 2FeCl3,
Fe2+ → Fe3+;
- складні йони металічних і неметалічних елементів, у яких вони мають проміжний ступінь окиснення:
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl,
S+4 → S+6;
Оскільки окисники – це речовини, що містять атоми, які приєднують електрони, то окисниками можуть бути речовини, що містять елементи не у нижчому ступені окиснення:
- неметали:
3Cl2 +2Fe = 2FeCl3,
Cl20 → 2Cl-1;
- катіони металічних елементів:
CuSO4 + Fe = FeSO4 + Cu,
Cu2+ → Cu0;
- складні йони або молекули:
5H2SO4 + 2P = 2H3PO4 + 5SO2 + 2H2O,
S+6 → S+4.
Висновки
Окисник приєднує електрони і відновлюється.
Відновник віддає електрони і окиснюється
Елемент, який знаходиться у вищому ступені окиснення, проявляє тільки окисні властивості.
Елемент, який знаходиться у нижчому ступені окиснення, проявляє тільки відновні властивості.
Якщо елемент має проміжний ступень окиснення, то він може проявляти властивості окисника і відновника залежно від властивостей речовин, з якими реагує.
4. Складання рівнянь окисно-відновних реакцій
Електронний баланс - метод знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, в якому розглядається обмін електронами між атомами елементів, які змінюють свій ступінь окиснення.
Основою цього методу є наступне правило:
загальне число електронів, які віддали атоми-відновники, дорівнює загальному числу електронів, які приєднали атоми-окисники.
Розглянемо, як підібрати коефіцієнти, методом електронного балансу для рівняння реакції взаємодії калій хлориду з калій біхроматом у присутності сульфатної кислоти.
Алгоритм добору коефіцієнтів методом електронного балансу.
1. Записуємо схему реакції:
KCl + K2Cr2O7 + H2SO4 → Cl2 +Cr2(SO4)3 + K2SO4 + H2O.
2. Визначаємо ступені окиснення елементів у реагентах і продуктах реакції:
+1 −1 +1 +6 −2 +1 +6 −2 0 +3 +6 −2 +1 +6−2 +1 −2
KCl + K2Cr2O7 + H2SO4 → Cl2 +Cr2(SO4)3 + K2SO4 + H2O.
3. Знаходимо елементи, які змінили свій ступінь окиснення.
У нашому випадку це Хлор і Хром.
4. Визначаємо число електронів, які приєднав окисник і віддав відновник. Записуємо рівняння напівреакцій процесів окиснення та відновлення, враховуючи мінімальну кількість атомів, які беруть участь у цих процесах.
Молекула хлору складається з двох атомів, а формульні одиниці K2Cr2O7 і Cr2(SO4)3 містять по два атоми Хрому, тому складаємо рівняння напівреакцій для двох атомів Хлору і Хрому. В такому випадку кількість електронів, які віддає або приєднує один атом помножуємо на 2:
2Cl− − 2ē = Cl20
2Cr+6 + 6ē = 2Cr+3
5. Складаємо електронний баланс.
Щоб зрівняти кількість відданих і прийнятих електронів, рівняння першої напівреакції треба помножити на 6, а другої – на 2. Для цього досить перемістити числа відданих і прийнятих електронів проти верхнього і нижнього рядка так, як показано на схемі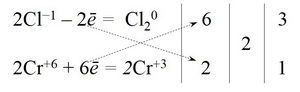
Щоб отримати мінімальні коефіцієнти числа 6 і 2, треба скоротити на 2, отримуємо коефіцієнти 3 і 1, які урівняють кількість відданих і прийнятих електронів.
6. Ці коефіцієнти ставимо перед речовинами, що містять елемент-окисник і елемент-відновник.
Зверніть увагу: оскільки ми визначали баланс для 2 атомів Хлору, то перед калій хлоридом ставимо загальний коефіцієнт 6.
6KCl+ K2Cr2O7 + H2SO4→3Cl2+Cr2(SO4)3 + K2SO4+H2O.
7. Добираємо коефіцієнти для всіх інших учасників реакції методом підбору.
6KCl+K2Cr2O7+ 7H2SO4=3Cl2+Cr2(SO4)3+ 4K2SO4 + 7H2O.
8. Перевіряємо правильність добору коефіцієнтів за елементом, який не зрівнювали. Найчастіше за Оксигеном:
7 + 7∙4 = 4∙3 + 4∙4 + 7
35 = 35.
9. Визначаємо окисник і відновник, процеси окиснення і відновлення: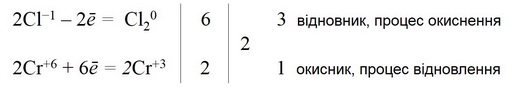
Відповідь: 6KCl + K2Cr2O 7+ 7H2SO4 = 3Cl2 + Cr2 (SO4)3 + 4K2SO4 + 7H2O.