Хімічна рівновага
2. Константа хімічної рівноваги
Розглянемо швидкості прямої і зворотної реакцій в стані хімічної рівноваги. Як приклад візьмемо деяку умовну реакцію:
аА + bВ ⇄ сС + dD
Швидкість прямої реакції виражається кінетичним рівнянням:
v1 = k1CAa ∙CBb,
а швидкість зворотної –
v2 = k2CCc ∙CDd.
Позначимо рівноважні концентрації речовин символами: [А], [В], [С] і [D]
Оскільки в стані рівноваги v1 = v2 , то k1[A]a[B]b = k2[C]c[D]d.
• Відношення констант швидкостей прямої і зворотної реакцій, що є постійною величиною, отримала назву константи хімічної рівноваги.
Константу рівноваги можна обчислити за формулою:
![]() .
.
Подібно константам швидкості прямої і зворотної реакцій, константа хімічної рівноваги також залежить від температури.
Це рівняння є математичним виразом закону діючих мас для стану хімічної рівноваги.
• Відношення добутків рівноважних концентрацій продуктів реакції і реагентів, зведених в ступені їх стехіометричних коефіцієнтів в рівнянні реакції, становить постійну величину при постійній температурі і називається константою рівноваги.
Наприклад, для процесу
2NО + O2 ⇄ 2NO2
константа рівноваги дорівнює:
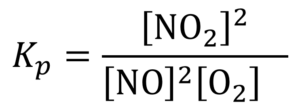
Константу хімічної рівноваги при певній температурі можна розрахувати з експериментальних даних, визначивши при цій температурі рівноважні концентрації реагентів і продуктів.
Чисельне значення константи рівноваги вказує на повноту протікання процесу в прямому або зворотному напрямку.
Якщо константа хімічної рівноваги більша за одиницю, то у рівноважній суміші переважають продукти реакції.
Наприклад, константа рівноваги реакції окиснення міді катіонами Аргентуму
Cu(тв) + 2Ag+(р-н) ⇄Cu2+(р-н) + 2Ag(тв)↓
дорівнює Крівн. = 2∙1015. Це означає, що швидкість прямої реакції у багато разів більше швидкості зворотної, і тому мідь, занурена в розчин солі Аргентуму, практично повністю витісняє срібло у вигляді металу.
Якщо константа хімічної рівноваги менша за одиницю, то у рівноважній суміші переважають вихідні речовини.
Значення константи рівноваги реакції розчинення барій сульфату
BaSO4(тв) ⇄ Ba2+(р-н) + SO42-(р-н)
Крівн. = 1,1·10-10 вказує на те, що в стані рівноваги барій сульфат лише в незначній мірі переходить в розчин у формі іонів.
Константа рівноваги не залежить від дії каталізатору.
Каталізатор прискорює в однаковій мірі швидкість прямої і зворотної реакцій, тому каталізатор не впливає на константу рівноваги.
Каталізатор прискорює процеси досягнення рівноваги, за рахунок пропорційного зниження енергій активації як прямого, так і зворотного процесів.
Якщо відома константа рівноваги, то можна розрахувати рівноважні концентрації речовин або ступінь перетворення реагентів в продукти реакції при заданому початковому складі.