Хімічна рівновага
| Сайт: | Online University from the Future |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Хімічна рівновага |
| Напечатано:: | Гість-користувач |
| Дата: | Воскресенье, 8 Февраль 2026, 16:09 |
1. Оборотні і необоротні процеси
Раніше ми розглядали хімічні реакції, умовно вважаючи, що вони йдуть до кінця, тобто реагенти повністю перетворюються на продукти реакції. Насправді ж такий стан справедливий лише для деяких реакцій, які називають необоротними. Це реакції
1) в розчинах, що супроводжуються утворенням газоподібного або практично нерозчинного продукту;
ВаСl2 + Н2SО4 = ВаSО4 + 2НСl
Nа2СО3 + 2 НСl = 2 NаСl + Н2О + CO2
2) утворюється слабкий електроліт, наприклад вода:
НСl + NаОН = Н2О + NаСl
3) реакція супроводжується великим виділенням енергії, наприклад горіння магнію:
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж/моль.
• Хімічні реакції, що протікають тільки в одному напрямку і завершуються повним перетворенням вихідних речовин у продукти реакції, називаються необоротними.
Більшість хімічних процесів є оборотними, наприклад, одночасно з утворенням амоніаку з азоту і водню
N2 + 3H2 = 2 NH3
відбувається процес розкладання амоніаку на азот і водень
2 NH3 = N2 + 3H2.
Такі реакції називають оборотними, а між лівою і правою частинами рівняння реакції ставлять знак «⇄»
N2 + 3H2 ⇄ 2 NH3.
• Хімічні реакції, що одночасно протікають в двох взаємно протилежних напрямках, називаються оборотними.
• Реакцію, що відбувається між речовинами, які записані в лівій частині рівняння, називають прямою, а протилежну реакцію – зворотною.
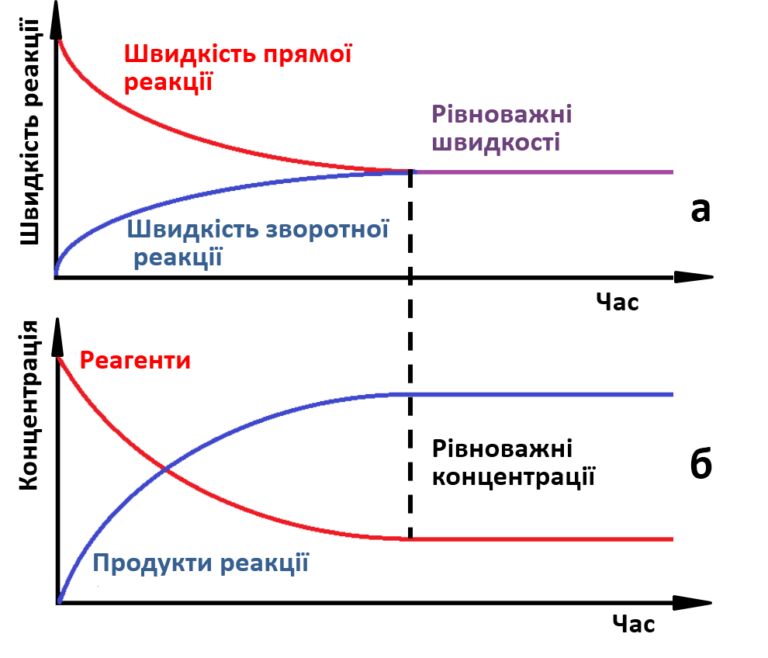
В ході реакції концентрація вихідних речовин поступово зменшується, а концентрація продуктів реакції збільшується. Відповідно швидкість прямої реакції знижується, а зворотної – підвищується. З часом буде досягнуто стан, при якому швидкості прямої і зворотної реакцій стануть однаковими, а концентрації реагентів і продуктів реакції перестануть змінюватися (мал. 1).
|
|
| Мал.1. а) Зміна швидкостей прямої і зворотної реакції з часом;
б) Зміна концентрації реагентів і продуктів з часом. |
• Стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної реакції, називається хімічною рівновагою.
• Концентрації реагентів і продуктів, що відповідають стану рівноваги, називаються рівноважними.
Незмінність концентрації реагентів і продуктів після встановлення рівноваги не означає, що в системі припинилися процеси взаємодії. Вони йдуть безперервно.
Наприклад, якщо суміш водню і йоду нагрівати при 410 °С в закритій посудині, то 78 % вихідних реагентів перетворюються на гідроген йодид. За цих же умов 22 % гідроген йодиду розпадається на водень і йод. Як в першому, так і в другому випадку встановлюється стан, який за даної температури характеризується постійним співвідношенням кількості водню, йоду і гідроген йодиду.
Зауважимо, що повністю необоротних реакцій немає, і будь-який з незворотних процесів, може бути перетворений в оборотний. Наприклад, розкладання кальцій карбонату – реакція необоротна, якщо здійснюється у відкритій системі, тобто в системі, в якій можливе видалення карбон(IV) оксиду зі сфери реакції
СаСО3 = СаО + СО2.
Разом з тим при здійсненні тієї ж реакції в замкнутій системі процес розкладання кальцій карбонату йде лише до того часу, поки в системі не встановиться цілком певний тиск, що перешкоджає подальшому розкладанню. В такому випадку ця реакція стає оборотною
СаСО3 ⇄ СаО + СО2.
2. Константа хімічної рівноваги
Розглянемо швидкості прямої і зворотної реакцій в стані хімічної рівноваги. Як приклад візьмемо деяку умовну реакцію:
аА + bВ ⇄ сС + dD
Швидкість прямої реакції виражається кінетичним рівнянням:
v1 = k1CAa ∙CBb,
а швидкість зворотної –
v2 = k2CCc ∙CDd.
Позначимо рівноважні концентрації речовин символами: [А], [В], [С] і [D]
Оскільки в стані рівноваги v1 = v2 , то k1[A]a[B]b = k2[C]c[D]d.
• Відношення констант швидкостей прямої і зворотної реакцій, що є постійною величиною, отримала назву константи хімічної рівноваги.
Константу рівноваги можна обчислити за формулою:
![]() .
.
Подібно константам швидкості прямої і зворотної реакцій, константа хімічної рівноваги також залежить від температури.
Це рівняння є математичним виразом закону діючих мас для стану хімічної рівноваги.
• Відношення добутків рівноважних концентрацій продуктів реакції і реагентів, зведених в ступені їх стехіометричних коефіцієнтів в рівнянні реакції, становить постійну величину при постійній температурі і називається константою рівноваги.
Наприклад, для процесу
2NО + O2 ⇄ 2NO2
константа рівноваги дорівнює:
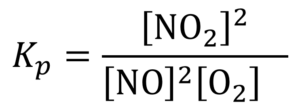
Константу хімічної рівноваги при певній температурі можна розрахувати з експериментальних даних, визначивши при цій температурі рівноважні концентрації реагентів і продуктів.
Чисельне значення константи рівноваги вказує на повноту протікання процесу в прямому або зворотному напрямку.
Якщо константа хімічної рівноваги більша за одиницю, то у рівноважній суміші переважають продукти реакції.
Наприклад, константа рівноваги реакції окиснення міді катіонами Аргентуму
Cu(тв) + 2Ag+(р-н) ⇄Cu2+(р-н) + 2Ag(тв)↓
дорівнює Крівн. = 2∙1015. Це означає, що швидкість прямої реакції у багато разів більше швидкості зворотної, і тому мідь, занурена в розчин солі Аргентуму, практично повністю витісняє срібло у вигляді металу.
Якщо константа хімічної рівноваги менша за одиницю, то у рівноважній суміші переважають вихідні речовини.
Значення константи рівноваги реакції розчинення барій сульфату
BaSO4(тв) ⇄ Ba2+(р-н) + SO42-(р-н)
Крівн. = 1,1·10-10 вказує на те, що в стані рівноваги барій сульфат лише в незначній мірі переходить в розчин у формі іонів.
Константа рівноваги не залежить від дії каталізатору.
Каталізатор прискорює в однаковій мірі швидкість прямої і зворотної реакцій, тому каталізатор не впливає на константу рівноваги.
Каталізатор прискорює процеси досягнення рівноваги, за рахунок пропорційного зниження енергій активації як прямого, так і зворотного процесів.
Якщо відома константа рівноваги, то можна розрахувати рівноважні концентрації речовин або ступінь перетворення реагентів в продукти реакції при заданому початковому складі.
3. Принцип Ле Шательє
Стан хімічної рівноваги при незмінних зовнішніх умовах може зберігатися як завгодно довго до того часу, поки не змінюються зовнішні умови. Зміна температури, тиску або концентрації реагентів виводять систему зі стану рівноваги.
Як тільки в системі порушується рівновага, швидкості прямої і зворотної реакцій стають неоднаковими і в системі переважно протікає процес, який знову викликають стан рівноваги, але вже відповідає новим умовам.
Напрям зміщення хімічної рівноваги визначається загальним положенням, відомим як принцип Ле Шательє (1884 р.).
• Якщо на систему, що знаходиться в стані рівноваги, впливати ззовні, змінюючи якийсь із факторів, що визначають положення рівноваги, то в системі посилиться той напрямок процесу, який послаблює цей вплив.
Вплив зміни температури на стан хімічної рівноваги
При підвищенні температури прискорюються як пряма, так і зворотна реакції, але по різному. Як правило, ендотермічний процес прискорюється в більшою мірою, ніж екзотермічний, а при зниженні температури швидше протікає екзотермічна.
При підвищенні температури рівновага зміщується в бік ендотермічної реакції, а при зниженні – в бік екзотермічної (відео 1)
Чим більший тепловий ефект реакції, тим сильніший вплив температури на зміщення рівноваги.
Вплив зміни тиску на стан хімічної рівноваги
При підвищенні тиску рівновагу реакції зміщується в напрямку утворення речовин, що займають менший об’єм, і, навпаки, зниження тиску сприяє процесу, що супроводжується збільшенням об’єму. Тобто
при підвищенні тиску хімічна рівновага зміщується в бік утворення меншої кількості молекул газуватих речовин, а при зниженні тиску – вбік збільшення кількості молекул газів.
Наприклад, перетворення нітроген(ІV) оксиду на його димер, яка відбувається в газовій фазі,
2 NO2(г) ⇄ N2O4(г)
призводить до зменшення кількості молекул газоподібних речовин, а значить до пониження тиску, а зворотня реакція перетворення N2O4 у NO2 – до збільшення кількості молекул і підвищення тиску.
За кімнатної температурі NO2 – газ темно-коричневого кольору (його називають «бурим» газом). Продукт його димеризації N2O4 – безбарвний. Обидва гази за звичайних умов присутні в суміші, тобто знаходяться в стані хімічної рівноваги. При зменшенні в такий системі тиску рівновага зсувається – в бік утворення NO2 і суміш набуває більш темного кольору (відео 2).
Вплив зміни концентрації на стан хімічної рівноваги
Якщо до системи, що знаходиться в стані рівноваги, додати хоча б одну з речовин, що беруть участь в реакції, то швидкості прямого і зворотного процесів зміняться, але таким чином, що система знову прийде в стан рівноваги. У цьому новому стані концентрації всіх речовин будуть відрізнятися від початкових, але співвідношення між ними,що визначається константою рівноваги, залишиться тим самим. Тобто, в рівноважній системі не можна змінити концентрацію тільки однієї речовини, не змінюючи концентрації всіх інших.