Хімічна рівновага
1. Оборотні і необоротні процеси
Раніше ми розглядали хімічні реакції, умовно вважаючи, що вони йдуть до кінця, тобто реагенти повністю перетворюються на продукти реакції. Насправді ж такий стан справедливий лише для деяких реакцій, які називають необоротними. Це реакції
1) в розчинах, що супроводжуються утворенням газоподібного або практично нерозчинного продукту;
ВаСl2 + Н2SО4 = ВаSО4 + 2НСl
Nа2СО3 + 2 НСl = 2 NаСl + Н2О + CO2
2) утворюється слабкий електроліт, наприклад вода:
НСl + NаОН = Н2О + NаСl
3) реакція супроводжується великим виділенням енергії, наприклад горіння магнію:
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж/моль.
• Хімічні реакції, що протікають тільки в одному напрямку і завершуються повним перетворенням вихідних речовин у продукти реакції, називаються необоротними.
Більшість хімічних процесів є оборотними, наприклад, одночасно з утворенням амоніаку з азоту і водню
N2 + 3H2 = 2 NH3
відбувається процес розкладання амоніаку на азот і водень
2 NH3 = N2 + 3H2.
Такі реакції називають оборотними, а між лівою і правою частинами рівняння реакції ставлять знак «⇄»
N2 + 3H2 ⇄ 2 NH3.
• Хімічні реакції, що одночасно протікають в двох взаємно протилежних напрямках, називаються оборотними.
• Реакцію, що відбувається між речовинами, які записані в лівій частині рівняння, називають прямою, а протилежну реакцію – зворотною.
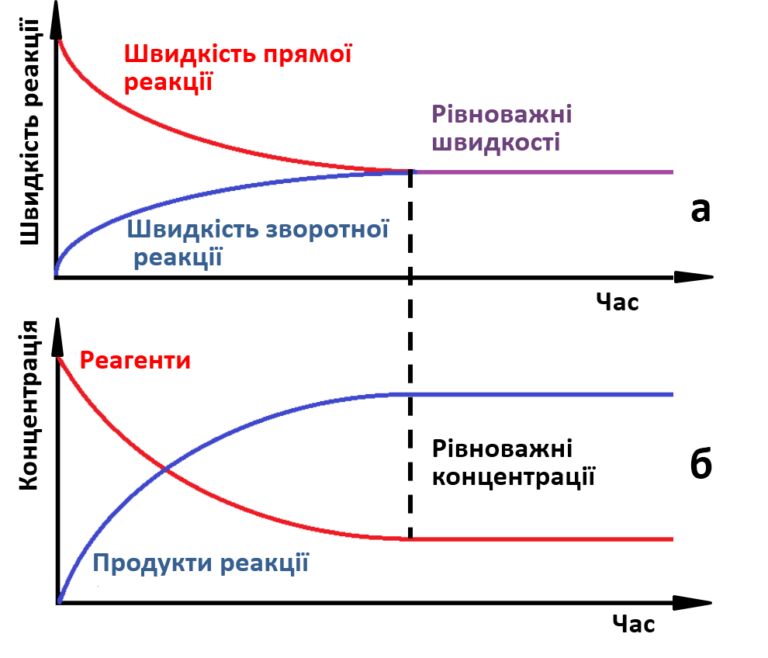
В ході реакції концентрація вихідних речовин поступово зменшується, а концентрація продуктів реакції збільшується. Відповідно швидкість прямої реакції знижується, а зворотної – підвищується. З часом буде досягнуто стан, при якому швидкості прямої і зворотної реакцій стануть однаковими, а концентрації реагентів і продуктів реакції перестануть змінюватися (мал. 1).
|
|
| Мал.1. а) Зміна швидкостей прямої і зворотної реакції з часом;
б) Зміна концентрації реагентів і продуктів з часом. |
• Стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної реакції, називається хімічною рівновагою.
• Концентрації реагентів і продуктів, що відповідають стану рівноваги, називаються рівноважними.
Незмінність концентрації реагентів і продуктів після встановлення рівноваги не означає, що в системі припинилися процеси взаємодії. Вони йдуть безперервно.
Наприклад, якщо суміш водню і йоду нагрівати при 410 °С в закритій посудині, то 78 % вихідних реагентів перетворюються на гідроген йодид. За цих же умов 22 % гідроген йодиду розпадається на водень і йод. Як в першому, так і в другому випадку встановлюється стан, який за даної температури характеризується постійним співвідношенням кількості водню, йоду і гідроген йодиду.
Зауважимо, що повністю необоротних реакцій немає, і будь-який з незворотних процесів, може бути перетворений в оборотний. Наприклад, розкладання кальцій карбонату – реакція необоротна, якщо здійснюється у відкритій системі, тобто в системі, в якій можливе видалення карбон(IV) оксиду зі сфери реакції
СаСО3 = СаО + СО2.
Разом з тим при здійсненні тієї ж реакції в замкнутій системі процес розкладання кальцій карбонату йде лише до того часу, поки в системі не встановиться цілком певний тиск, що перешкоджає подальшому розкладанню. В такому випадку ця реакція стає оборотною
СаСО3 ⇄ СаО + СО2.