Залежність швидкості реакції від температури та від наявності каталізатора
2. Теорія активних зіткнень
На перший погляд, збільшення швидкості реакції з підвищенням температури пов’язано зі збільшенням числа зіткнень молекул. Однак це не зовсім так. Згідно з розрахунками загальна кількість зіткнень молекул при збільшенні температури на десять градусів зростає тільки на 1,6%, а число молекул, що прореагували, зростає на 200-400 %.
Пояснити залежність швидкості реакції від температури можна в рамках теорії активних зіткнень Сванте Арреніуса, який припустив, що вплив температури зводиться головним чином до збільшення числа активних молекул, тобто молекул, зіштовхування яких призводить до утворення продукту (ефективні зіткнення).
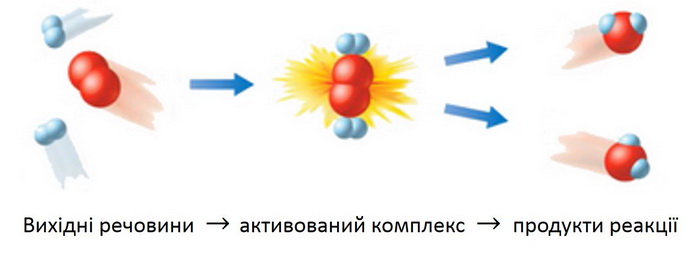
Для того, щоб молекули прореагували між собою, вони повинні спочатку зіткнутися. Причому зіткнення повинно бути досить енергійним. Енергія, що запасена в молекулах, повинна перевищувати певну величину – інакше вони просто відштовхуються одна від одної, не вступаючи в реакцію. Якщо ж енергія зіткнення достатня, утворюється продукт реакції (відео.1.).
Перетворення проходить через перехідний стан, який уявляє собою частинку, що відрізняється за своєю будовою (кутами, довжинами зв’язків) від частинок початкових і кінцевих речовин: старі хімічні зв’язки вже майже зруйнувалися, а нові, характерні для продуктів реакції, ще не встигли цілком сформуватися. Такі частинки мають високу енергію. Подібний стан в хімічній реакції називається активованим комплексом, який являє собою щось “середнє” між реагентами і продуктами реакції. Коливання атомів або груп в активованому комплексі призводить до його розпаду і утворенню продуктів реакції) (рис. 1.)
Візуальне уявлення про енергетичні зміни, що відбуваються з речовинами, дає графічне зображення енергетики хімічної реакції (рис. 2)

Енергію, що потрібна для досягнення системою активованого комплексу, який перетворюється в продукти реакції вже мимовільно, називається енергією активації.
• Енергія активації (Еа) – різниця між енергією активованого комплексу і енергією вихідних речовин.
Енергія активації обумовлена енергетичним бар’єром, який слід подолати молекулам, що стикаються, перш ніж відбудеться перерозподіл зв’язків. Цей бар’єр обумовлений електростатичним відштовхуванням електронних оболонок молекул, які реагують (відео 2).
Підвищення температури призводить до збільшення частки молекул, енергія яких дорівнює або більше енергії активації, що призводить до збільшення константи швидкості реакції, тобто зростанню швидкості реакції.
Активація молекул може бути досягнута підведенням не тільки теплоти, але й інших видів енергії: променевої, електричної або енергії радіоактивних частинок.
Для різних хімічних реакцій енергія активації різна і може змінюватися від 5 до 500 кДж/моль. Чим вища енергія активації, тим важче «змусити йти» цю реакцію, тим менша швидкість реакції.