Залежність швидкості реакції від температури та від наявності каталізатора
| Сайт: | Онлайн-університет майбутнього |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Залежність швидкості реакції від температури та від наявності каталізатора |
| Надруковано: | Guest user |
| Дата: | неділя, 8 лютий 2026, 16:24 |
1. Правило Вант-Гоффа
Залежність швидкості реакції від температури приблизно визначається емпіричним правилом Вант-Гоффа:
при підвищенні температури на кожні 10 градусів швидкість, хімічної реакції зростає в 2-4 рази.
Це правило математично виражається рівнянням
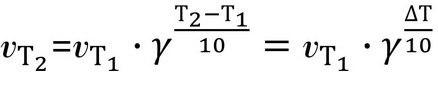
де vT1 і vT2 – швидкості реакції відповідно при температурах Т1 і Т2.
γ – температурний коефіцієнт константи швидкості реакції (число, що показує, у скільки разів зміниться константа швидкості реакції при підвищенні температури на кожні 10 градусів).
Якщо відомий температурний коефіцієнт, можна розрахувати зміну швидкості реакції при зміні температури від Т1 до Т2 за формулою
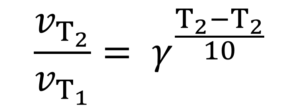
Наприклад, якщо температурний коефіцієнт дорівнює 2, то при збільшенні температури на 50 оС v2/v1=25=32, а саме швидкість реакції збільшується в 32 рази. Причому це прискорення ніяк не залежить від абсолютних величин Т1 і Т2, а тільки від їх різниці.
Тобто, при підвищенні температури в арифметичній прогресії швидкість реакції зростає в геометричній прогресії.
Температурний коефіцієнт вираховується за формулою:
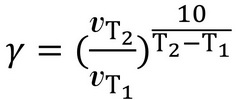 .
.
2. Теорія активних зіткнень
На перший погляд, збільшення швидкості реакції з підвищенням температури пов’язано зі збільшенням числа зіткнень молекул. Однак це не зовсім так. Згідно з розрахунками загальна кількість зіткнень молекул при збільшенні температури на десять градусів зростає тільки на 1,6%, а число молекул, що прореагували, зростає на 200-400 %.
Пояснити залежність швидкості реакції від температури можна в рамках теорії активних зіткнень Сванте Арреніуса, який припустив, що вплив температури зводиться головним чином до збільшення числа активних молекул, тобто молекул, зіштовхування яких призводить до утворення продукту (ефективні зіткнення).
Для того, щоб молекули прореагували між собою, вони повинні спочатку зіткнутися. Причому зіткнення повинно бути досить енергійним. Енергія, що запасена в молекулах, повинна перевищувати певну величину – інакше вони просто відштовхуються одна від одної, не вступаючи в реакцію. Якщо ж енергія зіткнення достатня, утворюється продукт реакції (відео.1.).
Перетворення проходить через перехідний стан, який уявляє собою частинку, що відрізняється за своєю будовою (кутами, довжинами зв’язків) від частинок початкових і кінцевих речовин: старі хімічні зв’язки вже майже зруйнувалися, а нові, характерні для продуктів реакції, ще не встигли цілком сформуватися. Такі частинки мають високу енергію. Подібний стан в хімічній реакції називається активованим комплексом, який являє собою щось “середнє” між реагентами і продуктами реакції. Коливання атомів або груп в активованому комплексі призводить до його розпаду і утворенню продуктів реакції) (рис. 1.)
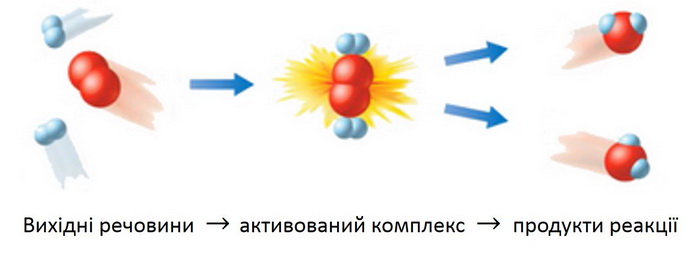
Візуальне уявлення про енергетичні зміни, що відбуваються з речовинами, дає графічне зображення енергетики хімічної реакції (рис. 2)

Енергію, що потрібна для досягнення системою активованого комплексу, який перетворюється в продукти реакції вже мимовільно, називається енергією активації.
• Енергія активації (Еа) – різниця між енергією активованого комплексу і енергією вихідних речовин.
Енергія активації обумовлена енергетичним бар’єром, який слід подолати молекулам, що стикаються, перш ніж відбудеться перерозподіл зв’язків. Цей бар’єр обумовлений електростатичним відштовхуванням електронних оболонок молекул, які реагують (відео 2).
Підвищення температури призводить до збільшення частки молекул, енергія яких дорівнює або більше енергії активації, що призводить до збільшення константи швидкості реакції, тобто зростанню швидкості реакції.
Активація молекул може бути досягнута підведенням не тільки теплоти, але й інших видів енергії: променевої, електричної або енергії радіоактивних частинок.
Для різних хімічних реакцій енергія активації різна і може змінюватися від 5 до 500 кДж/моль. Чим вища енергія активації, тим важче «змусити йти» цю реакцію, тим менша швидкість реакції.
3. Каталіз
Ефективним способом упливу на швидкість перебігу реакцій є використання каталізаторів.
• Каталізатор – речовина, що бере участь у реакції та змінює її швидкість, але сама в реакції не витрачається.
Процес зміни швидкості хімічної реакції під дією каталізаторів називається каталізом, а реакції, що відбуваються за участю каталізатора, – каталітичними. Наприклад, розклад гідроген пероксиду прискорюється манган(IV) оксидом (мал.1).
 |
| Мал. 1. Розкладання гідроген пероксиду під дією манган(ІV) оксиду. |
У хімічних рівняннях каталізатор не вказують ані в реагентах, ані в продуктах реакції, а записують його над знаком рівності, наприклад:

Розрізняють гетерогенний і гомогенний каталіз.
При гомогенному каталізі каталізатор і реагенти утворюють одну фазу.
Механізм гомогенного каталізу пояснюється теорією проміжних сполук. А саме, якщо повільну реакцію А + В = АВ, що характеризується великою енергією активації, провести в присутності каталізатора К, то він вступає у взаємодію з однією з вихідних речовин, утворюючи нетривку проміжну сполуку:
А + К = АК.
Реакція протікає швидко, тому що енергія активації цього процесу мала. Потім проміжна сполука АК взаємодіє з іншим реагентом або розкладається, при цьому каталізатор вивільняється у початковому стані:
АК + В = АВ + К.
Енергія активації цього процесу також мала, а тому реакція протікає з достатньою швидкістю. Ці процеси можна проілюструвати графіком (мал. 2)
|
|
| Мал. 2. Порівняння енергетичних діаграм реакції без застосування каталізатора і реакції за участю каталізатора |
Прикладом гомогенного каталізу можуть служити реакції в озоновому шарі Землі, які описав Пауль Крутцен - голландський хімік, лауреат Нобелівської премії. Озон - це відносно нестабільна молекула, що розкладається з утворенням кисню:
2О3 = 3О2.
Швидкість цієї реакції збільшується під дією нітроген(ІІ) оксиду, який діє як каталізатор за наступним механізмом:
O2(г.) = 2O(г.);
NO(г.) + O3(г.) = NO2(г.) + O2(г.); (1)
NO2(г.) + O(г.) = NO(г.) + O2(г.). (2)
Оскільки в цьому випадку каталізатор на проміжних стадіях є реагентом у гомогенних реакціях, то швидкість реакцій в гомогенному каталізі залежить від концентрації каталізатора.
При гетерогенному каталізі каталізатор і реагенти знаходяться в різних фазах.
Найчастіше каталізатор твердий, а реагенти знаходяться в газовій або рідкій фазі. У цьому випадку реакція відбувається на поверхні твердого каталізатора.
Прикладом гетерогенного каталізу є, окиснення сульфур(ІV) оксиду до сульфур(VІ) оксиду на каталізаторі ванадій(V) оксиді. Під час цього процесу відбуваються наступні реакції
SO2(г.) + V2O5(тв.) = SO2(г.) + V2O4(тв.); (3)
V2O4(тв.) + 1/2О2(г.) = V2O5(тв.). (4)
Таким чином ванадій(V) оксид є реагентом реакції (3) і продуктом - реакції (4). Обидві реакції є гетерогенними, тому швидкість реакцій в гетерогенному каталізі залежить від площі поверхні каталізатора.
Для збільшення площі поверхні каталізаторів їх виготовляють у вигляді гранул (мал. 3а), наносять на пористі керамічні та металеві підложки (мал.3б) або скловолокнисті матеріали (мал.3в).
|
|
|
|
|
а |
б |
в |
Мал. 3. Зовнішній вигляд промислових каталізаторів:
а) гранульовані каталізатори; б) каталізатори на спінених керамічних і металевих носіях; в) каталізатори на скловолокнистих носіях



