Залежність швидкості реакції від температури та від наявності каталізатора
1. Правило Вант-Гоффа
Залежність швидкості реакції від температури приблизно визначається емпіричним правилом Вант-Гоффа:
при підвищенні температури на кожні 10 градусів швидкість, хімічної реакції зростає в 2-4 рази.
Це правило математично виражається рівнянням
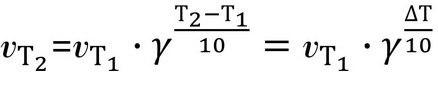
де vT1 і vT2 – швидкості реакції відповідно при температурах Т1 і Т2.
γ – температурний коефіцієнт константи швидкості реакції (число, що показує, у скільки разів зміниться константа швидкості реакції при підвищенні температури на кожні 10 градусів).
Якщо відомий температурний коефіцієнт, можна розрахувати зміну швидкості реакції при зміні температури від Т1 до Т2 за формулою
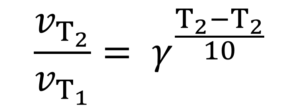
Наприклад, якщо температурний коефіцієнт дорівнює 2, то при збільшенні температури на 50 оС v2/v1=25=32, а саме швидкість реакції збільшується в 32 рази. Причому це прискорення ніяк не залежить від абсолютних величин Т1 і Т2, а тільки від їх різниці.
Тобто, при підвищенні температури в арифметичній прогресії швидкість реакції зростає в геометричній прогресії.
Температурний коефіцієнт вираховується за формулою:
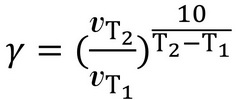 .
.