Закон Гесса
1. Закон Гесса
|
|
|
Герман Іванович Гесс. У 1840 р. відкрив закон термохімії |
Закон Гесса:
тепловий ефект хімічної реакції при постійному об’ємі або тиску не залежить від шляху реакції, а визначається лише початковим й кінцевим станами системи.
Згідно цього закону, якщо з наданих вихідних речовин можна різними способами отримати одні і ті ж кінцеві продукти, то незалежно від шляху отримання, тобто від числа і виду проміжних реакцій, сумарний тепловий ефект для всіх випадків буде однаковим.
На малюнку 1 схематично зображено процес перетворення деяких вихідних речовин А, В, С у продукти D, E, F, який може бути здійснений різними шляхами:
- прямим перетворенням із тепловим ефектом ΔН1.
- проходженням двох послідовних реакцій із тепловими ефектами ΔН2, ΔН3.
- перетворенням, що відбувається у три стаді з тепловими ефектами ΔН4, ΔН5, ΔН6.
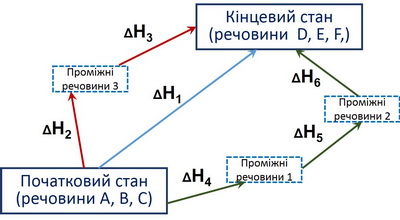 |
| Мал. 1. Ілюстрація до закону Гесса. |
Відповідно, тепловий ефект реакції перетворення речовин А, В, С на D, E, F, можна або виміряти експериментально під час проведення реакції в одну стадію (ΔН1), або обчислити за формулою:
ΔН1 = ΔН2 + ΔН3 = ΔН4 + ΔН5 + ΔН6.
За законом Гесса можна обчислити теплові ефекти будь-яких проміжних, навіть гіпотетичних, реакцій на шляху перетворення одних речовин в інші.
Наприклад, тепловий ефект окиснення графіту до карбон(ІІ) оксиду виміряти неможливо, оскільки одночасно з цією реакцією завжди проходить реакція утворення карбон(ІV) оксиду.
Для визначення теплового ефекту окиснення графіту до карбон(ІІ) оксиду (ΔН3) використаємо теплові ефекти реакцій окиснення графіту до карбон(ІV) оксиду(ΔН1) та окиснення карбон(ІІ) оксиду до карбон(ІV) оксиду(ΔН2) (мал.2):
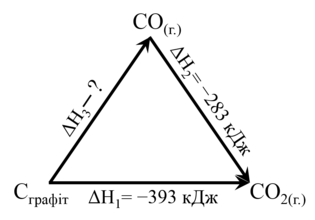 |
| Мал. 2. Схема перетворення графіту на оксиди карбону |
Реакцію окиснення графіту до карбон(ІV) оксиду можна розглядати як суму двох послідовних реакцій окиснення графіту до карбон(ІІ) оксиду та карбон(ІІ) оксиду до карбон (ІV) оксиду:
| С + О2=СО2; ΔН1= -393 кДж, | (1) |
| СО+ ½ О2=СО2; ΔН2= -283 кДж. | (2) |
Відповідно, за законом Гесса ентальпія реакції окиснення графіту до карбон(ІV) оксиду є сумою ентальпій реакцій (1) І (2):
ΔН1= ΔН3 + ΔН2.
З цього рівняння отримуємо ентальпію окиснення графіту до карбон(ІV) оксиду:
ΔН3=ΔН1 – ΔН2=-393 кДж – (-283 кДж) = -110 кДж.
Тобто термохімічне рівняння окиснення графіту до карбон(ІІ) оксиду має вигляд
С+ ½ О2=СО; ΔН= -110 кДж.
