Закон Гесса
| Сайт: | Онлайн-університет майбутнього |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Закон Гесса |
| Надруковано: | Гість-користувач |
| Дата: | неділя, 8 лютий 2026, 18:02 |
1. Закон Гесса
|
|
|
Герман Іванович Гесс. У 1840 р. відкрив закон термохімії |
Закон Гесса:
тепловий ефект хімічної реакції при постійному об’ємі або тиску не залежить від шляху реакції, а визначається лише початковим й кінцевим станами системи.
Згідно цього закону, якщо з наданих вихідних речовин можна різними способами отримати одні і ті ж кінцеві продукти, то незалежно від шляху отримання, тобто від числа і виду проміжних реакцій, сумарний тепловий ефект для всіх випадків буде однаковим.
На малюнку 1 схематично зображено процес перетворення деяких вихідних речовин А, В, С у продукти D, E, F, який може бути здійснений різними шляхами:
- прямим перетворенням із тепловим ефектом ΔН1.
- проходженням двох послідовних реакцій із тепловими ефектами ΔН2, ΔН3.
- перетворенням, що відбувається у три стаді з тепловими ефектами ΔН4, ΔН5, ΔН6.
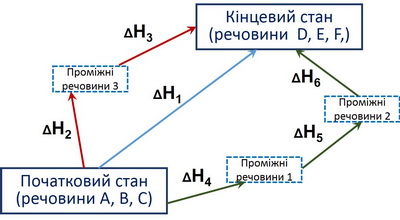 |
| Мал. 1. Ілюстрація до закону Гесса. |
Відповідно, тепловий ефект реакції перетворення речовин А, В, С на D, E, F, можна або виміряти експериментально під час проведення реакції в одну стадію (ΔН1), або обчислити за формулою:
ΔН1 = ΔН2 + ΔН3 = ΔН4 + ΔН5 + ΔН6.
За законом Гесса можна обчислити теплові ефекти будь-яких проміжних, навіть гіпотетичних, реакцій на шляху перетворення одних речовин в інші.
Наприклад, тепловий ефект окиснення графіту до карбон(ІІ) оксиду виміряти неможливо, оскільки одночасно з цією реакцією завжди проходить реакція утворення карбон(ІV) оксиду.
Для визначення теплового ефекту окиснення графіту до карбон(ІІ) оксиду (ΔН3) використаємо теплові ефекти реакцій окиснення графіту до карбон(ІV) оксиду(ΔН1) та окиснення карбон(ІІ) оксиду до карбон(ІV) оксиду(ΔН2) (мал.2):
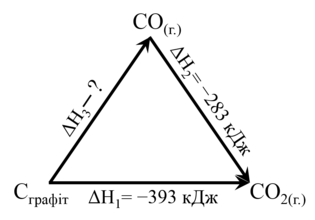 |
| Мал. 2. Схема перетворення графіту на оксиди карбону |
Реакцію окиснення графіту до карбон(ІV) оксиду можна розглядати як суму двох послідовних реакцій окиснення графіту до карбон(ІІ) оксиду та карбон(ІІ) оксиду до карбон (ІV) оксиду:
| С + О2=СО2; ΔН1= -393 кДж, | (1) |
| СО+ ½ О2=СО2; ΔН2= -283 кДж. | (2) |
Відповідно, за законом Гесса ентальпія реакції окиснення графіту до карбон(ІV) оксиду є сумою ентальпій реакцій (1) І (2):
ΔН1= ΔН3 + ΔН2.
З цього рівняння отримуємо ентальпію окиснення графіту до карбон(ІV) оксиду:
ΔН3=ΔН1 – ΔН2=-393 кДж – (-283 кДж) = -110 кДж.
Тобто термохімічне рівняння окиснення графіту до карбон(ІІ) оксиду має вигляд
С+ ½ О2=СО; ΔН= -110 кДж.
2. Застосування закону Гесса для обчислення теплових ефектів реакцій
На підставі закону Гесса з термохімічними рівняннями можна оперувати так само, як і з алгебраїчними.
Термохімічні рівняння реакцій можна
- додавати і віднімати,
- множити і ділити на будь-яке число крім нуля,
- записувати справа наліво, не зважаючи увагу на те, що зворотні реакції іноді не можуть бути здійснені.
Під час проведення розрахунків треба враховувати перший наслідок із закону Гесса: тепловий ефект прямої реакції точно дорівнює за величиною і протилежний за знаком тепловому ефекту зворотної реакції. Це твердження ще називають законом Лавуазьє - Лапласа.
Розглянемо, як розв'язують задачі на визначення теплових ефектів реакції з використанням закону Гесса.
Теплові ефекти залежать від зовнішніх умов, тому для того, щоб можна було порівнювати теплові ефекти різних процесів і проводити розрахунки, обирають однакові умови – стандартні умови (тиск 101,3 кПа і температура 298,5 K).
Ентальпії реакцій за стандартних умов позначають ΔНо298.
Приклад 1.
| Використовуючи термохімічні рівняння | |
| СО(г.) + 1/2О2(г.) = СО2(г.); ΔНо = – 283 кДж, | (1) |
| Сu(тв.) + 1/2О2(г.) = СuО(тв.); ΔНо = – 155 кДж, | (2) |
| обчисліть зміну ентальпії для наступної реакції: | |
| СuО(тв.) + СО(г.) = Сu(тв.) + СО2(г.); ΔН0 – ? | (3) |
Розв'язання.
1. З’ясуємо, які алгебраїчні дії треба застосувати до двох наданих рівнянь, щоб отримати рівняння реакції, тепловий ефект якої потрібно визначити.
Для цього порівняємо, у яких частинах цих рівнянь знаходяться формули речовин останньої реакції.
Карбон(ІІ) оксид знаходиться в лівих частинах як першого, так і третього рівнянь, тому перше рівняння залишаємо без зміни:
СО(г.) + 1/2О2(г.) = СО2(г.); ΔНо1 = – 283 кДж,
Купрум(ІІ) оксид знаходиться у різних частинах другого і третього рівнянь (у правій частині в другому рівнянні та у лівій частині в третьому рівнянні). Тому, щоб перемістити СuО вліво треба перевернути друге рівняння справа наліво, тобто записати рівняння зворотної реакції і змінити знак ентальпії на протилежний:
СuО (тв.) = Сu(тв.) + 1/2О2(г.); ΔНо4 = + 155 кДж. (4)
2. Додамо рівняння (1) і (4) одне до одного
СО(г.) + 1/2О2(г.) + СuО (тв.) = СО2(г.) + Сu(тв.) + 1/2О2(г.);
Як бачимо, кисень знаходиться у лівій і правій частинах рівняння, тому скоротимо його і отримаємо
СО(г.) + СuО (тв.) = СО2(г.) + Сu(тв.);
Отже, ентальпія цієї реакції дорівнює сумі ентальпій реакцій (1) і (4)
ΔН03 = ΔН02 + ΔН04 = – 283 кДж + 155 кДж = – 128 кДж.
Відповідь: СuО(тв.) + СО(г.) = Сu(тв.) + СО2(г.); ΔН0 = – 128 кДж.
Приклад 2.
|
Визначте ентальпію реакції: |
|
|
CS2(р.) + 3O2(г.) = CO2(г.) + 2SO2(г.), |
(1) |
|
користуючись термохімічними рівняннями: |
|
|
C(тв.) + O2(г.) = CO2(г.); ΔH02 = −393,5 кДж, |
(2) |
|
S(тв.) + O2(г.) = SO2(г.); ΔH03 = −296,8 кДж, |
(3) |
|
C(тв.) + 2S(тв.) = CS2(р.); ΔH04 = +87,9 кДж. |
(4) |
Розв’язання.
1. З’ясуємо, які алгебраїчні дії треба застосувати до рівнянь (2) – (4), щоб отримати рівняння реакції (1).
CO2 знаходиться в правих частинах рівнянь (1) і (2), тому рівняння (2) залишаємо без зміни:
C(тв.) + O2(г.) = CO2(г.); ΔHо = −393,5 кДж,
SO2 знаходиться в правих частинах рівнянь (1) і (3), але в рівнянні (1) перед SО2 стоїть коефіцієнт 2, а в рівнянні (3) – коефіцієнт 1. На підставі цього, рівняння (3) треба помножити на 2, відповідно, у два рази збільшити і ентальпію:
|
2S(тв.) + 2O2(г.) = 2SO2(г.); ΔHо = −593,6 кДж. |
(5) |
CS2 знаходиться у протилежних частинах рівнянь (1) і (4), тому рівняння (4) потрібно перевернути справа наліво і поміняти знак ентальпії:
|
CS2(р.) = C(тв.) + 2S(тв.); ΔHо = –87,9 кДж. |
(6) |
Щоб отримати рівняння (1) необхідно скласти рівняння (2), (5) і (6):
C(тв.) + O2(г.) +2S(тв.) + 2O2(г.) + CS2(р.) = CO2(г.) + 2SO2(г.) + C(тв.) + 2S(тв.).
Скоротимо вуглець і сірку, що знаходяться в протилежних частинах рівняння і отримаємо рівняння (1):
CS2(р.) + 3O2(г.) = CO2(г.) + 2SO2(г.).
Ентальпія цієї реакції дорівнює сумі ентальпій реакцій (2), (5) і (6).
ΔНо1 = ΔНо2 + ΔНо5 + ΔНо6
Враховуючи те, що
ΔНо5 = 2ΔНо3
ΔНо6 = −ΔНо4,
ентальпію реакції (1) можна обчислити за формулою
ΔНо1 = ΔНо2 + 2ΔНо3 – ΔНо4= −393,5 кДж + (−593,6 кДж) – 87,9 кДж = – 1083,1 кДж.
Відповідь: CS2(р.) + 3O2(г.) = CO2(г.) + 2SO2(г.); ΔНо = – 1083,1 кДж.
3. Обчислення ентальпії реакції за стандартними ентальпіями утворення речовин
Найчастіше для термохімічних розрахунків застосовують ентальпію утворення сполук з простих речовин.
• Стандартна ентальпія утворення речовини – це тепловий ефект реакції утворення 1 моль складної речовини з простих речовин, визначений за стандартних умов (ΔHоутв., кДж/моль).
Стандартні ентальпії утворення більшості відомих речовин можна знайти в довідниках. Стандартні ентальпії утворення простих речовин у найбільш стійких формах прийняли такими, що дорівнюють нулю.
Наприклад,
| ΔHоутв.(О2) = 0 кДж/моль, | а ΔHоутв.(О3) = 142,5 кДж/моль, |
| ΔHоутв.(Сграфіт) = 0 кДж/моль, | а ΔHоутв.(Салмаз) = 1,9 кДж/моль. |
Обчислення теплових ефектів реакції проводять за наслідком з закону Гесса:
• ентальпія хімічної реакції дорівнює різниці між сумою ентальпій утворення продуктів і сумою ентальпій утворення вихідних речовин з врахуванням стехіометричних коефіцієнтів речовини в рівнянні реакції.
Якщо хімічна реакція відбувається відповідно до рівняння
aA+bB=cC+dD,
то ΔHореакції = с∙ΔHоутв.(С) + d∙ΔHоутв.(D) – (a∙ΔHоутв.(A) + b∙ΔHоутв.(B)).
Завдання 1.
Визначити тепловий ефект реакції відновлення ферум(ІІІ) оксиду карбон(ІІ) оксидом, використовуючи наведені стандартні ентальпії утворення речовин, і складіть термохімічне рівняння цієї реакції.
|
Формула речовини |
ΔHоутв., кДж/моль |
|
Fe2O3(тв.) |
–824,2 |
|
CO(г.) |
–110,5 |
|
CO2(г.) |
–393,5 |
Розв’язання
1. Складемо хімічне рівняння
Fe2O3(тв.) +3CO(г.) = 2Fe(тв.) + 3CO2(г.)
2. Знаходимо стандартну ентальпію реакції, враховуючи, що стандартна ентальпія утворення простої речовини заліза дорівнює нулю:
ΔHореакції = 3∙ΔHоутв.(CO2(г.)) – (ΔHоутв.( Fe2O3(тв.)) + 3∙ΔHоутв.( CO(г.)))=
= 3∙(–393,5) –((–824,2) + 3∙(–110,5)) = –24,8 кДж.
Відповідь: Fe2O3(тв.) +3CO(г.) = 2Fe(тв.) + 3CO2(г.); ΔHо = –24,8 кДж.
