Середня швидкість хімічної реакції
3. Середня швидкість хімічної реакції
• Середня швидкість гомогенної реакції визначається зміною кількості речовини реагенту або продукту реакції в одиниці об'єму суміші за одиницю часу.
v = ±Δn/(V·Δt),
де Δn – зміна кількості речовини (n2-n1), моль;
V – об'єм суміші, л;
Δt – відрізок часу (t2-t1), с;
v – швидкість хімічної реакції, моль/(л·с).
Якщо реакція відбувається в сталому об'ємі, то швидкість реакції можна виразити через зміну молярної концентрації речовин (С=n/V):
v = ± ΔС/Δt
ΔС – зміна концентрації речовини (С2-С1), моль/л;
Швидкість реакції можна вимірювати за зміною концентрації як реагентів, так і продуктів реакції. З часом концентрації реагентів зменшуються, отже, С2-С1 <0, а оскільки швидкість реакції завжди позитивна, то перед дробом слід поставити знак «-». Якщо швидкість реакції обчислювати за зміною продукту реакції, концентрація якого поступово збільшується, тому С2-С1 >0, перед дробом слід поставити знак «+».
Швидкість реакції можна вимірювати за зміною концентрації будь-якого з реагентів або продуктів, але чисельне значення швидкості залежить від цього вибору, наприклад, розглянемо реакцію взаємодії азоту з воднем:
N2 + 3H2 =2NH3.
Якщо під час цієї реакції прореагує 1 моль азоту і 3 моль водню, то утвориться 2 моль амоніаку.
Залежність концентрації будь-якого учасника реакції від часу можна представити у вигляді графіків (мал. 1).
|
|
| Мал.1. Кінетичні криві втрачання азоту і водню, та утворення амоніаку |
Отже, швидкість, яку виміряно за зменшенням водню, не дорівнює швидкості, яку виміряно за зменшенням азоту, або за збільшенням амоніаку.

Значення швидкості витрачання N2, Н2, та утворення NН3 різні, але пов’язані між собою співвідношенням 1: 3: 2, які дорівнюють співвідношенню кількості речовин за рівнянням реакції.
• Середньою швидкістю хімічної реакції називається відношення швидкості утворення продукту реакції, або швидкості витрачання вихідної речовини, до відповідного стехіометричного коефіцієнта.
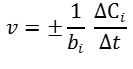
• Швидкість гетерогенних реакцій вимірюється кількістю речовини, що вступає в реакцію або, що утворюється за одиницю часу, на одиниці поверхні:
v = ±Δn/(S·Δt).
