Середня швидкість хімічної реакції
| Сайт: | Онлайн-університет майбутнього |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Середня швидкість хімічної реакції |
| Надруковано: | Гість-користувач |
| Дата: | неділя, 8 лютий 2026, 19:25 |
1. Поняття про хімічну кінетику
Реакції можуть проходити з різною швидкістю.
Миттєво відбуваються реакції, які супроводжуються вибухом, наприклад, взаємодія водню з киснем.
Швидко, але не миттєво горить залізо в хлорі.
З іншого боку, існує велика кількість реакцій, що протікають протягом більш тривалого часу: декількох годин або років. Прикладом таких реакцій є корозія металів, руйнування під дією кислотних дощів пам’ятників і архітектурних споруд з мармуру та вапняку тощо.
При виборі реакцій для використання їх у промисловості одним з вирішальних параметрів є їхня швидкість, оскільки вона обумовлює продуктивність і ефективність виробництва.
• Розділ хімії, що вивчає швидкість хімічних процесів і вплив на них різних чинників, називається хімічною кінетикою.
Вплив природи реагентів на швидкість хімічної реакції
Щоб речовини вступили в реакцію зв’язки між частинками необхідно розірвати. Тому швидкість хімічної реакції залежить від
- типу і міцності хімічних зв’язків в молекулах реагентів, що мають молекулярну будову
- будови і міцності кристалічної ґратки речовин немолекулярної будови (іонних або атомних кристалів)
- будови електронної оболонки атома, міцності зв’язування зовнішніх електронів в атомах металів, благородних газів.
Вплив природи реагентів на швидкість реакції можна побачити під час дослідження взаємодії металів з хлоридною кислотою, спостерігаючи за виділенням бульбашок водню: цинк реагує швидше заліза, а мідь не реагує зовсім (відео 1). В цьому випадку швидкість хімічної реакції залежить від електродного потенціалу металу.
- Згадайте, що таке стандартний електрохімічний потенціал.
У цинку стандартний електродний потенціал менший ніж у заліза, тому цинк легше окиснюється. У міді електродний потенціал більший за електродний потенціал водню, тому мідь не відновлює водень з кислот.
Інший приклад – взаємодія металу, наприклад, цинку з сильною кислотою і слабкою. Сила кислот залежить від міцності зв’язку між атомом Гідрогену і елементом кислотного залишку.
2. Класифікація хімічних реакцій за наявністю межі поділу фаз
Для визначення швидкості хімічної реакції треба врахувати, що реакції бувають гомогенні і гетерогенні.
• Гомогенними називають реакції, які відбуваються в усьому об’ємі системи, що складається з однієї фази.
Гомогенні реакції рівномірно протікають у всьому об’ємі газової суміші (наприклад суміші водню з киснем), або рідкого розчину декількох речовин в одному розчиннику, наприклад, натрій карбонату і сульфатної кислоти у воді, реакція нейтралізації тощо.
• Гетерогенні – реакції, що відбуваються в системах, які складаються більш ніж з однієї фази.
Гетерогенні реакції проходять тільки на поверхні поділу фаз: там, де речовини, що реагують, можуть контактувати. Наприклад, на поверхні твердої речовини, яка взаємодіє з рідиною чи газом, або на поверхні рідини, що взаємодіє з газуватою речовиною. Гетерогенними є і реакції між двома рідинами, якщо ці рідини не змішуються між собою, та реакції між речовинами у твердому стані. Прикладами гетерогенних реакцій можуть бути горіння твердих речовин, взаємодія металів з кислотами, вуглекислого газу з основними оксидами й кристалічними лугами та інші.
3. Середня швидкість хімічної реакції
• Середня швидкість гомогенної реакції визначається зміною кількості речовини реагенту або продукту реакції в одиниці об'єму суміші за одиницю часу.
v = ±Δn/(V·Δt),
де Δn – зміна кількості речовини (n2-n1), моль;
V – об'єм суміші, л;
Δt – відрізок часу (t2-t1), с;
v – швидкість хімічної реакції, моль/(л·с).
Якщо реакція відбувається в сталому об'ємі, то швидкість реакції можна виразити через зміну молярної концентрації речовин (С=n/V):
v = ± ΔС/Δt
ΔС – зміна концентрації речовини (С2-С1), моль/л;
Швидкість реакції можна вимірювати за зміною концентрації як реагентів, так і продуктів реакції. З часом концентрації реагентів зменшуються, отже, С2-С1 <0, а оскільки швидкість реакції завжди позитивна, то перед дробом слід поставити знак «-». Якщо швидкість реакції обчислювати за зміною продукту реакції, концентрація якого поступово збільшується, тому С2-С1 >0, перед дробом слід поставити знак «+».
Швидкість реакції можна вимірювати за зміною концентрації будь-якого з реагентів або продуктів, але чисельне значення швидкості залежить від цього вибору, наприклад, розглянемо реакцію взаємодії азоту з воднем:
N2 + 3H2 =2NH3.
Якщо під час цієї реакції прореагує 1 моль азоту і 3 моль водню, то утвориться 2 моль амоніаку.
Залежність концентрації будь-якого учасника реакції від часу можна представити у вигляді графіків (мал. 1).
|
|
| Мал.1. Кінетичні криві втрачання азоту і водню, та утворення амоніаку |
Отже, швидкість, яку виміряно за зменшенням водню, не дорівнює швидкості, яку виміряно за зменшенням азоту, або за збільшенням амоніаку.

Значення швидкості витрачання N2, Н2, та утворення NН3 різні, але пов’язані між собою співвідношенням 1: 3: 2, які дорівнюють співвідношенню кількості речовин за рівнянням реакції.
• Середньою швидкістю хімічної реакції називається відношення швидкості утворення продукту реакції, або швидкості витрачання вихідної речовини, до відповідного стехіометричного коефіцієнта.
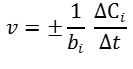
• Швидкість гетерогенних реакцій вимірюється кількістю речовини, що вступає в реакцію або, що утворюється за одиницю часу, на одиниці поверхні:
v = ±Δn/(S·Δt).
4. Залежність швидкості гетерогенної реакції від площі поверхні контакту реагентів
Чим більше площа поверхні, тим вище ймовірність зіткнення, тим вище швидкість реакції (мал. 1).
|
|
|
Мал. 1. Вплив площі поверхні контакту речовин на швидкість гетерогенної реакції |
Збільшити площу поверхні контакту речовин можна шляхом зменшення розмірів частинок реагенту.
Уявіть собі куб, довжина кожної сторони якого становить 2 см. Площа однієї грані куба буде 2х2 = 4 см2. Куб має шість граней, тому загальна площа поверхні становить 4 см 2x6 = 24 см2.
Якщо розріжемо цей куб по горизонталі і вертикалі уздовж кожної грані, то отримаємо вісім кубиків з довжиною кожної сторони 1 см, площа поверхні якої 1 см х 1 см = 1 см2. Уся площа поверхні кожного такого куба 6 см2. Загальна площа поверхні восьми кубиків складає 6 см2 x 8 = 48 см2. Тобто загальна площа поверхні збільшилась у два рази (мал. 2).
|
|
| Мал. 2. Вплив подрібнення речовин на загальну площу поверхні. |
Тому, щоб збільшити площу поверхні частинок, тверді речовини, які беруть участь в гетерогенній реакції, подрібнюють. (Відео 1).
Наприклад, вугілля для приготування пороху розтирають в порошок. Рідину для реакції з газом розпилюють на дрібні крапельки: так, бензин за допомогою спеціального пристрою, що забезпечує розпилення, вприскують у карбюратор, де паливо змішується з повітрям.
Щоб розпалити багаття, під дрова підкладають дрібні скіпочки або хвою, а під них – зім’ятий папір, збільшуючи площу поверхні речовин, що легко спалахують, від яких і займається все багаття. Навпаки, гасіння пожежі водою полягає в зменшенні площі зіткнення палаючих предметів з повітрям.
На виробництві використовують так званий киплячий шар. Тверду речовину для підвищення швидкості реакції подрібнюють майже до стану пилу, а потім через нього пропускають знизу іншу речовину, як правило газоподібну.


