Залежність швидкості реакції від концентрації реагентів і тиску
| Сайт: | Онлайн-університет майбутнього |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Залежність швидкості реакції від концентрації реагентів і тиску |
| Надруковано: | Гість-користувач |
| Дата: | неділя, 8 лютий 2026, 19:43 |
1. Вплив концентрації реагентів на швидкість хімічної реакції
Вплив концентрації реагентів можна пояснити на основі теорії зіткнень, згідно з якою хімічна взаємодія є результатом зіткнення частинок речовин, що вступають в реакцію. Збільшення числа частинок в об’ємі призводить до підвищення частоти їхніх зіткнень (Рис. 1), а значить до збільшення швидкості реакції.
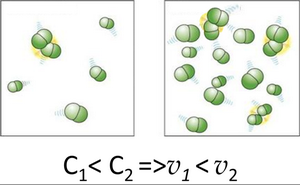 |
| Мал. 1. Збільшення числа частинок в об’ємі призводить до підвищення частоти їхніх зіткнень |
Більшість хімічних реакцій є складними процесами, під час яких можуть відбуватися декілька послідовних і паралельних стадій, що відбуваються з різною швидкістю. Тому надалі будемо розглядати залежність швидкості від концентрації тільки елементарних реакцій – одностадійних реакцій, які не можуть бути представлені простішими хімічними перетвореннями.
Закон, який встановлює співвідношення між концентрацією реагентів і швидкістю реакції отримав назву закон діючих мас.
• Швидкість елементарної хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, взятих у ступенях, що дорівнюють відповідним стехіометричним коефіцієнтам.
Нехай гомогенна хімічна реакція описується рівнянням
аА + bВ = dD,
де А, В і D – деякі речовини у газоподібному або рідкому стані;
а, b і d – стехіометрічні коефіцієнти в рівнянні реакції.
Тоді математичний вираз закону діючих мас (так зване кінетичне рівняння) має наступний вигляд:
v = kCa(A)∙Cb(В),
де С(А) і С(В) – молярні концентрації речовин А і В;
а і b – стехіометрічні коефіцієнти в рівнянні реакції;
k – коефіцієнт пропорційності, який називається константою швидкості реакції.
Наприклад, для реакції, що описується рівнянням реакції
2SO2(г) + O2(г) = 2SO3(г),
вираз для швидкості реакції має наступний вигляд
v = kC2(SO2)C(O2).
Константа швидкості реакції залежить від природи реагуючих речовин, температури, каталізатора і не залежить від концентрації речовин.
Фізичний зміст константи швидкості можна встановити якщо прийняти, що CA = CB = 1 моль/л. Тоді k = v, тому константа швидкості чисельно дорівнює швидкості, з якою реагують речовини при концентрації, що дорівнює 1 моль/л.
Константа швидкості дозволяє врахувати розходження між одиницями швидкості та концентрації. Оскільки швидкість реакції зазвичай виражається в моль/(л∙с), то одиниці константи швидкості будуть визначатися сумою показників ступенів (а + b) в кінетичному рівнянні хімічної реакції – порядком реакції.
Щоб вивести одиницю константи швидкості реакції скористаємось формулою
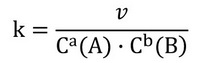
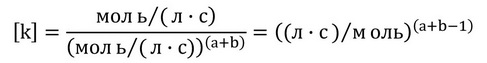 .
.
Швидкість гетерогенної реакції (наприклад, взаємодія газу чи рідини з твердою речовиною) за умови незмінності ступеня подрібнення твердої речовини (сталості поверхні розділу фаз) залежить тільки від концентрації речовини, що знаходиться в рідкій чи газоподібній фазі.
Наприклад, для гетерогенної реакції, що описується рівнянням реакції
СаО (т) + СО2(г) = СаСО3(т),
швидкість залежить лише від концентрації газоподібного реагента, а вираз для швидкості реакції має наступний вигляд
v = kC(СO2).
2. Вплив тиску на швидкість хімічної реакції
На швидкість реакції може впливати тиск тільки у випадку якщо серед реагентів є газоподібні сполуки. Тиск і об’єм газу пов’язані з концентрацією і взаємно пов’язані між собою.
 |
|
Мал. 2. Взаємозв’язок між об’ємом, тиском і концентрацією речовин |
Саме тому зміна тиску впливає на швидкість реакції між газоподібними речовинами таким чином, що і пропорційна йому зміна концентрації усіх компонентів.
Розглянемо, як обчислюють зміну швидкості реакції зі зміною тиску.
Задача.
Визначити у скільки разів підвищиться швидкість реакції окиснення сульфур(IV) оксиду
2SO2 (г) + O2 (г) = 2SO3 (г),
якщо об’єм газової суміші зменшити в три рази?
Розв’язання
До зміни об’єму швидкість реакції виражалася рівнянням:
υ1 = kС12(SO2) С1(O2).
Внаслідок зменшення об’єму концентрація кожної з реагуючих речовин зросте в три рази, отже:
С2(SO2) = 3(SO2),
С2(O2) = 3С1(O2),
υ2= k (3С1(SO2) )2 (3С1(O2)),
υ2/υ1=k (3С1(SO2) )2 (3С1(O2))/kС12(SO2) С1(O2) = 32·3 =27.
Відповідь: швидкість реакції зростає в 27 разів.
Рідини і тверді речовини нестисливі, тому вплив тиску на швидкість протікання реакції у рідкий і твердій фазах надзвичайно мізерний і ним можна знехтувати.