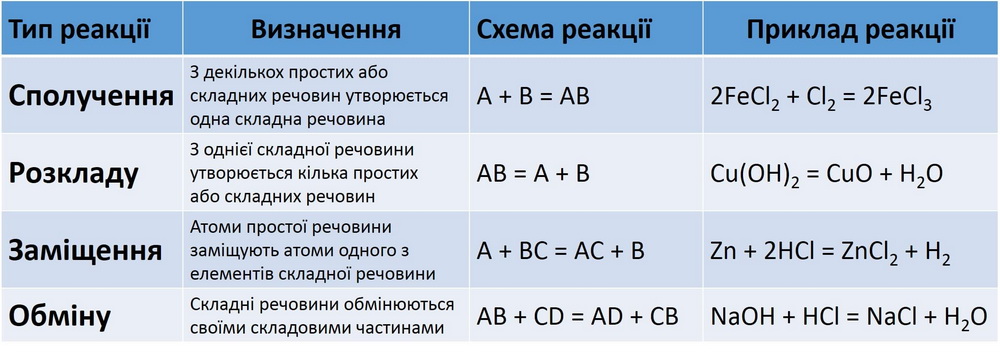
Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій
| Сайт: | Online University from the Future |
| Курс: | І місце. Хімічні реакції та закономірності їх перебігу (Кічата Олена Євгеніївна, Харківська гімназія № 46 ім. М.В.Ломоносова) |
| Книга: | Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій |
| Напечатано:: | Гість-користувач |
| Дата: | Воскресенье, 8 Февраль 2026, 16:05 |
1. Класифікація реакцій за кількістю та складом реагентів і продуктів реакції
.
2. Реакції сполучення
Реакції сполучення — це реакції, у яких з кількох речовин утворюється одна.
У реакції сполучення можуть вступати як прості, так і складні речовини.
1. Реакції сполучення двох простих речовин:
а) взаємодія металів з неметалами, наприклад,
2. Сполучення простої та складної речовин:
а) взаємодія нижчих оксидів з киснем
SO2 + O2 = 2SO3;
б) взаємодія вищих оксидів з простою речовиною, що утворена тим же елементом, що й оксид
2CO2 + С = 2CO;
в) взаємодія оксигенвмісних кислот і їх солей, що містять елемент у нижчому ступені окиснення, з киснем
2H2SO3 + O2 = 2H2SO4.
3. Сполучення двох складних речовин:
а) взаємодія кислотних оксидів з водою
SO3 + H2O = H2SO4;
б) взаємодія основних оксидів з водою
K2O + H2O = 2KOH;
г) взаємодія кислотних оксидів з основними або амфотерними оксидами
MgO + CO2 = MgCO3;
ZnO + SO2 = ZnSO3.
4. Сполучення трьох речовин і більше
K2CO3 + CO2 + H2O = 2KHCO3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Кількість останніх реакцій мала.
3. Реакції заміщення
• Реакції заміщення — це реакції між простою і складною речовиною, у результаті яких утворюються нові речовини (інші проста і складна).
Найчастіше у реакціях заміщення беруть участь прості речовини метали.
1. Взаємодія металів з кислотами:
Zn + 2HCl = ZnCl2 + H2↑.
2. Взаємодія лужних і лужноземельних металів з водою:
Ca + 2H2O = Ca(OH)2 + H2↑.
3. Взаємодія металу з сіллю менш активного металічного елемента, що міститься у водному розчині:
Zn + СuCl2 = ZnCl2 + Cu.
2Al + Fe2O3 = Al2O3 + 2Fe.
5. Взаємодія неметалу з оксидом металічного елемента:
Н2 + CuO = Cu + H2O;
C + PbO = Pb + CO.
6. Взаємодія галогену з сіллю, кислотний залишок якої є йоном менш активного галогену:
Cl2 + 2KBr = 2KCl + Br2.
4. Реакції обміну
• Реакції обміну — це реакції між двома складними речовинами, під час яких речовини обмінюються своїми складовими частинами (атомами, йонами, групами атомів).
До таких реакцій належать реакції електролітів (основ, кислот, солей), що відбуваються в розчинах за умови утворення нерозчинних речовин або слабких електролітів:
• між кислотою та основою (реакцію між кислотою та основою, у результаті якої утворюються сіль і вода, називають реакцією нейтралізації):
H2SO4 + 2KOH = K2SO4 + 2H2O;
• між сіллю й кислотою:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl;
K2CO3 + 2HCl = 2KCl + CO2↑+ H2O;
• між сіллю й лугом:
6KOH + Al2(SO4)3 = 2Al(OH)3↓ + 3K2SO4;
• взаємодії двох солей:
MgCl2 + 2AgNO3 = 2AgCl↓ + Mg(NO3)2;
• взаємодії кислоти з основним або амфотерним оксидом:
3K2O + 2H3PO4 = 2K3PO4 + 3H2O;
ZnO + 2HNO3 = Zn(NO3)2 + H2O.
5. Реакції розкладу
• Реакції розкладу — це реакції, під час яких з однієї складної речовини утворюється кілька речовин.
Продуктами розкладу можуть бути дві (рідше — три або більше) прості або складні речовини.
Реакції розкладу відбуваються зазвичай під час нагрівання, однак є деякі речовини, які розкладаються за звичайних умов (карбонатна, сульфітна кислоти).
1. Оксигенвмісні кислоти розкладаються на кислотний оксид і воду:
H2СO3 = СO2↑ + H2O.
2. Основні і амфотерні гідроксиди при нагріванні розкладаються на відповідний оксид і воду:
2Fe(OH)3 = Fe2O3 + 3H2O.
3. Більшість солей оксигенвмісних кислот при нагріванні розкладаються на основний або амфотерний і кислотний оксиди:
CaCO3 = CaO + CO2↑.
4. Якщо оксид, що утворюється під час розкладання, сам є термічно нестійким, то утворюються також продукти і його розпаду, наприклад:
2Ag2CO3 = 4Ag + 2CO2↑ + O2↑;
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑.
5. Термічно нестійкими є
- оксиди металічних елементів, що менш активні ніж Купрум. Вони розкладаються на метал і кисень:
2Ag2O = 2Ag + O2↑;
- деякі кислотні оксиди, що розкладаються на кисень і оксид з меншим ступенем окиснення елемента, наприклад нітроген(V) оксид розкладається на кисень і нітроген(ІV) оксид:
2N2O5 = 4NO2↑ + O2↑.
Не розкладаються:
• натрій гідроксид і калій гідроксид (NaOH, KOH);
• карбонати, утворені Калієм і Натрієм (K2СO3, Na2СO3);
• сульфати, утворені Калієм і Натрієм (K2SO4, Na2SO4).